EOB・プリモビスト®︎注シリンジ
What’s new
2024年10月23日(水) 「大腸癌肝転移の画像診断のUP to Date」を掲載しました。
2023年9月14日(木)(終了しました)EOB・プリモビスト バイエル画像診断WEBカンファレンス「膵癌集学的治療の画像評価におけるMRI診断の役割」を再配信いたします。
2023年8月1日(火)(終了しました)EOB・プリモビスト バイエル画像診断WEBカンファレンス「膵癌集学的治療の画像評価におけるMRI診断の役割」を配信いたします。
動画ライブラリ
EOB・プリモビスト注®シリンジに関連する症例紹介動画やガイドラインを基にした解説動画などをご案内いたします。
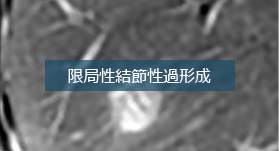
肝臓MRI入門シリーズ
肝臓MRI入門シリーズを公開しています。
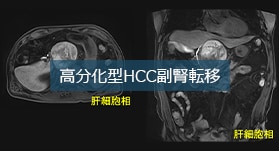
文献紹介
EOB・プリモビスト注®シリンジに関連する文献をご案内いたします。
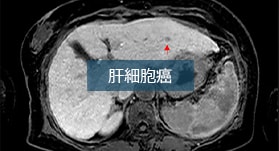
関連お役立ちコンテンツ
EOB・プリモビスト注®シリンジに関するお役立ちコンテンツをご案内いたします。
製品概要
EOB・プリモビスト注®シリンジは、シエーリングAG(現 バイエルAG)が開発したガドキセト酸ナトリウム(略号:Gd-EOB-DTPA)を有効成分とする磁気共鳴コンピューター断層撮影(Magnetic Resonance Imaging:MRI)用造影剤です。
開発の経緯
本剤は、細胞外液に非特異的に分布するMRI用造影剤(細胞外液性造影剤)であるガドペンテト酸(略号:Gd-DTPA)※1分子に、脂溶性側鎖であるエトキシベンジル基(Ethoxybenzyl:EOB)が導入された構造を有しており、T1強調画像においてガドリニウムイオン(Gd3+)による信号増強効果を示します。
また本剤は、静脈内投与後、血管内及び細胞間隙に非特異的に分布したのち、EOBの導入により肝細胞内に特異的に取り込まれます(日本人健康成人男子に本剤0.1mL/kgを投与した場合、投与後 4 日目までに投与量の 57% が尿中に、39%が糞中に排泄されました)。しかし、悪性腫瘍など肝細胞機能を消失あるいは保有していない病巣には取り込まれず、肝細胞機能の差異により病巣と周囲の肝組織とのコントラストを増強します。 したがって本剤の投与により、従来の細胞外液性造影剤と同様の血流動態に基づく情報に加え、肝細胞への特異的な取り込みに基づく組織機能の情報を得ることができ、肝腫瘍の診断能向上が期待されます。
本邦では1994年に臨床試験を開始し、本邦及び欧米で実施した臨床試験の成績から本剤の有効性及び安全性が確認され、2007 年 10 月、「磁気共鳴コンピューター断層撮影における肝腫瘍の造影」の効能・効果を有するMRI用肝臓造影剤として承認されました。
2008年1月の販売開始以降、2013年8月にかけて、使用成績調査,製造販売後臨床試験等から本剤の安全性及び有効性データを収集し、その成績をまとめて2016年1月に再審査申請を行いました。その結果、2017年3月30日付で厚生労働省より、本剤の「効能・効果,用法・用量等のいずれの承認内容も変更の必要なし」との再審査結果が公示されました。
※1 販売中止・薬価削除済
製品の特性
- 国内初の肝細胞特異性を有する線状型MRI用造影剤です。
- 1回の投与で、肝腫瘍の血流評価と肝細胞機能の評価が可能です。
- 肝腫瘍において、優れた診断能を示します。
- プレフィルドシリンジ製剤です。
- 副作用
重大な副作用としてショック、アナフィラキシー(いずれも頻度不明)、腎性全身性線維症(頻度不明)があらわれることがあります。主な副作用は、そう痒、発疹、頭痛、めまい、血圧上昇、呼吸困難、悪心、嘔吐、下痢、味覚倒錯、嗅覚錯誤、注射部位反応(疼痛等)、血管拡張(熱感,潮紅)、錯感覚(いずれも0.1~1%未満)でした。
電子添文の副作用及び臨床成績の安全性の結果をご参照ください。
効能又は効果
磁気共鳴コンピューター断層撮影における肝腫瘍の造影
用法及び用量
通常,成人には本剤0.1mL/kgを静脈内投与する
引用元:EOB・プリモビスト注 製品情報情報概要