症例・導⼊事例
※ご紹介する症例は臨床症例の一部を紹介したもので、全ての症例が同様な結果を示すわけではありません。
膵癌に対するdual energy CTの利用
施設名: 東京医科大学病院
執筆者: 放射線科 河合 亮兒 先生、齋藤 和博 先生
作成年月:2024年11月
※ 効能又は効果、用法及び用量、警告・禁忌を含む注意事項等情報等については、電子添文をご参照ください。
はじめに
症例背景
60歳代、女性、38kg、膵体尾部癌
検査目的
背部痛および膵腫瘍マーカー上昇
使用造影剤
イオプロミド300注シリンジ100mL「BYL」/ 76mL
症例解説
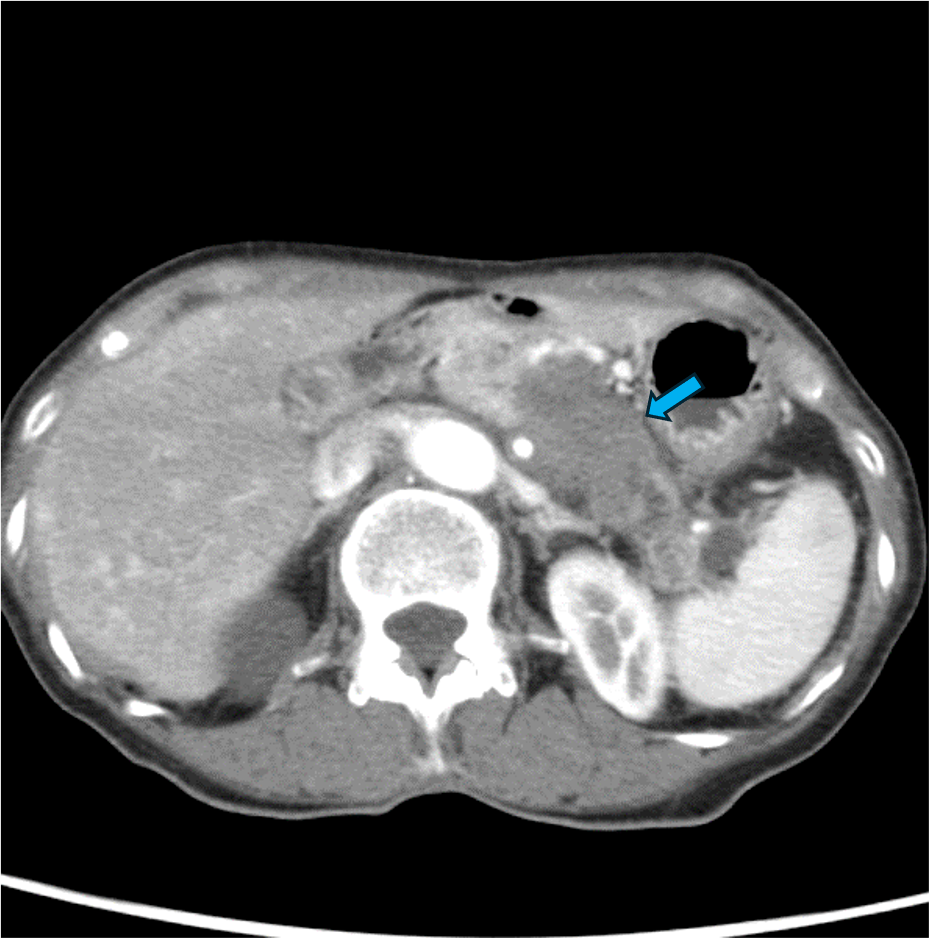
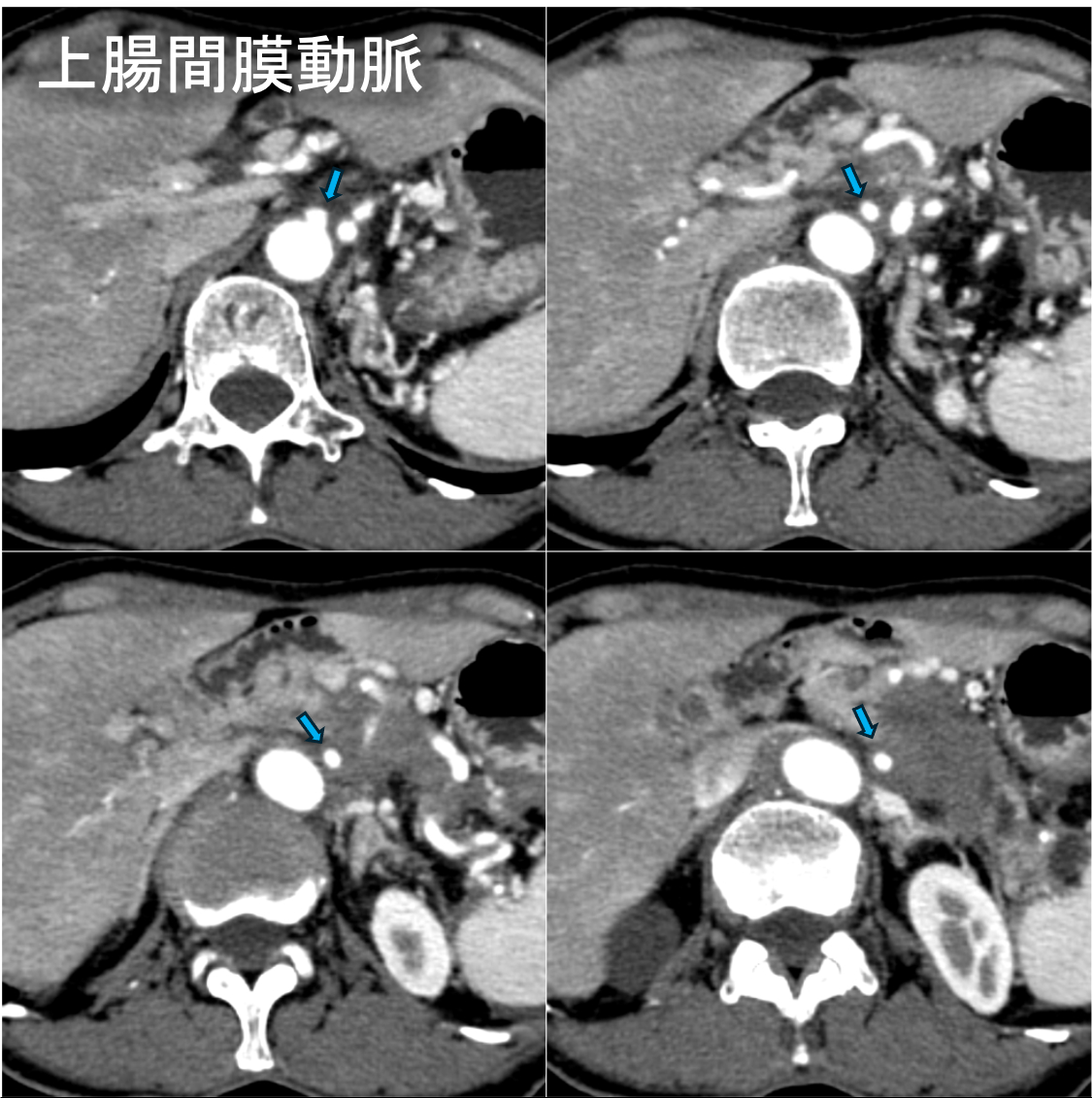
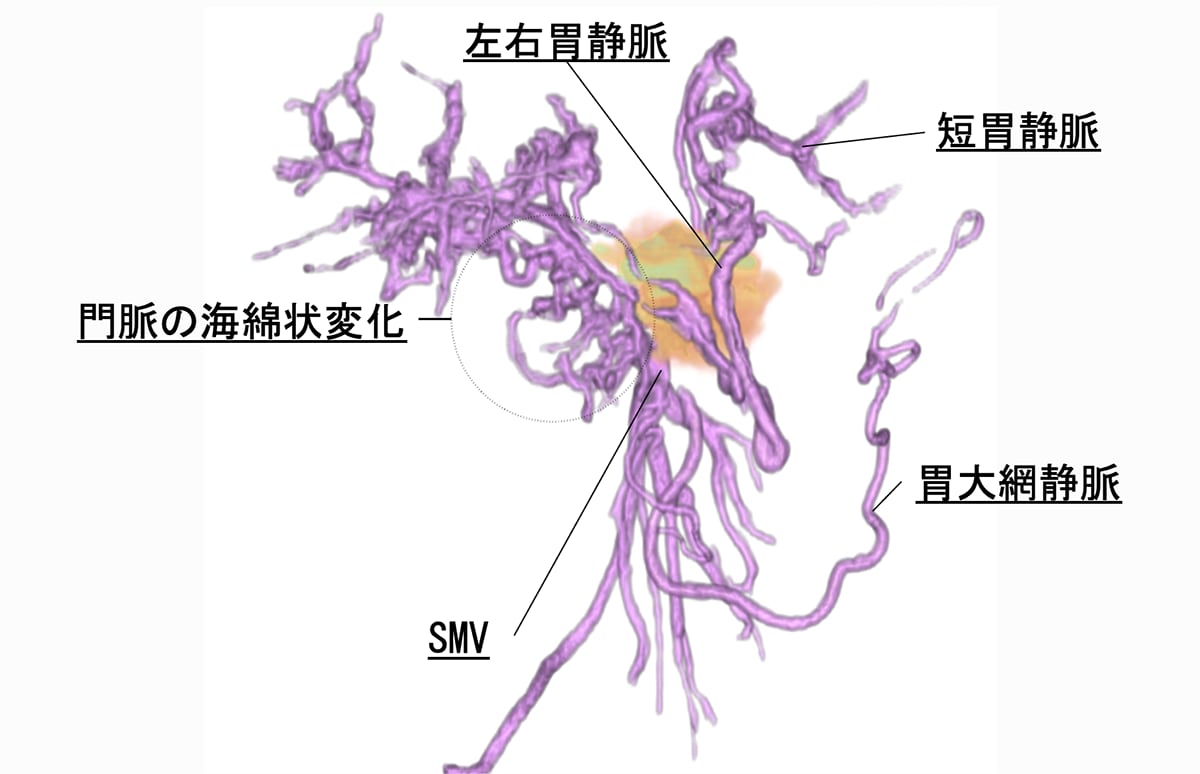
60歳台女性。心窩部痛と背部痛を主訴に来院。内視鏡を施行したところ、胃食道静脈瘤を認めたため内視鏡的静脈瘤結紮術を実施した。しかし、その後も背部痛は継続し、体重減少も出現した。腫瘍マーカーCA19-9、DUPAN-2の高値も認めたため悪性腫瘍精査目的にDynamic CTが撮影された。CTにて膵尾部腫瘍が認められた。腫瘍は腹腔動脈(CeA)、上腸間膜動脈(SMA)、門脈本幹(PV)、上腸間膜静脈(SMV)に浸潤を認めた。CTにてUnresectableと診断され、化学療法が施行された。
画像所見
撮影プロトコル
表は横スクロールでご覧いただけます。
| 使用機器 | CT機種名/メーカー名 | Revolution / GE |
| CT検出器の列数/スライス数 | 256 / 256 | |
| ワークステーション名/メーカー名 | VINCENT WORKSTATION / 富士フィルムメディカル |
撮影条件
表は横スクロールでご覧いただけます。
| 撮影時相 | 単純 | 動脈相 | 門脈相 | 平衡相 |
| 管電圧 (kV) | 80-140 | 80-140 | 80-140 | 80-140 |
| AEC | 有 | 有 | 有 | 有 |
| (AECの設定) | SD12 | SD12 | SD12 | SD12 |
| ビーム幅 (mm) | 80 | 80 | 80 | 80 |
| 撮影スライス厚 (mm) | 5 | 5 | 5 | 5 |
| 焦点サイズ | LARGE BODY | LARGE BODY | LARGE BODY | LARGE BODY |
| スキャンモード | Helical | Helical | Helical | Helical |
| スキャン速度(sec/rot) | 0.5 | 0.5 | 0.5 | 0.5 |
| ピッチ | 0.508 | 0.508 | 0.508 | 0.508 |
| スキャン範囲 | 腹部 | 腹部 | 胸服骨盤 | 胸服骨盤 |
| 撮影方向 | 頭→足 | 頭→足 | 頭→足 | 頭→足 |
再構成条件
表は横スクロールでご覧いただけます。
| 単純 | 動脈相 | 門脈相 | 平衡相 | |
| ルーチン:再構成スライス厚/間隔 (mm/mm) | 5 / 5 | 5 / 5 | 5 / 5 | 5 / 5 |
| ルーチン:再構成関数/逐次近似応用法 | STD / ASIR30 | STD / ASIR30 | STD / ASIR30 | STD / ASIR30 |
| 3D/MPR用:再構成スライス厚/間隔 (mm/mm) | 1.25 / 1.25 | 1.25 / 1.25 | 1.25 / 1.25 | 1.25 / 1.25 |
| 3D/MPR用:再構成関数/逐次近似応用法 | STD/DLIR(LOW) | STD/DLIR(LOW) | STD/DLIR(LOW) | STD/DLIR(LOW) |
造影条件
| 自動注入器機種名/メーカー名 | Dual Shot GX7 / 根本杏林堂 |
| 造影剤名 | イオプロミド300注シリンジ |
表は横スクロールでご覧いただけます。
| 撮影プロトコル | 動脈相 | 門脈相 | 平衡相 |
| 造影剤:投与量 (mgI/Kg) | 600 | ||
| 造影剤:注入時間 (sec) | 30 | ||
| 生食:投与量 (cc) | 20 | ||
| 生食:注入速度 (mL/sec)、注入時間 (sec) | ー | ||
| スキャンタイミング(造影剤注入開始後) | 固定法 42sec | 固定法 65sec | 固定法 180sec |
| 留置針サイズ (G) | 22 | ||
| 注入圧リミット (kg/cm2) | 10 | ||
造影剤量は体重当たりのヨード量は600mgIで造影、門脈相で胸部から撮影することでVARIXのルールアウトも兼ねている。
当該疾患の診断における造影CTの役割
通常型膵癌はdesmoplastic反応すなわち間質の線維化が強く、周囲の組織を巻き込みながら成長する。また一般的に阻血に抵抗性で腫瘍内出血や壊死、脂肪変性は起こしにくい。Dynamic CTでは乏血性で浸潤性増殖を呈する腫瘍として描出され、他の膵腫瘍の鑑別に有用である。CTは、腫瘍の大きさ、周囲組織への浸潤、リンパ節転移、遠隔転移の有無などを評価できるため、腫瘍の進展度を正確に診断し、適切な治療方針を決定するための重要な情報が得られる。特に、局所における切除の可否の決定に動脈系と門脈系への浸潤の有無を評価することが重要である。膵癌取扱い規約(JPS)第7版ではUnresectable、borderline resectableに関する事項が追加され、CT診断において記載すべき重要な項目である。
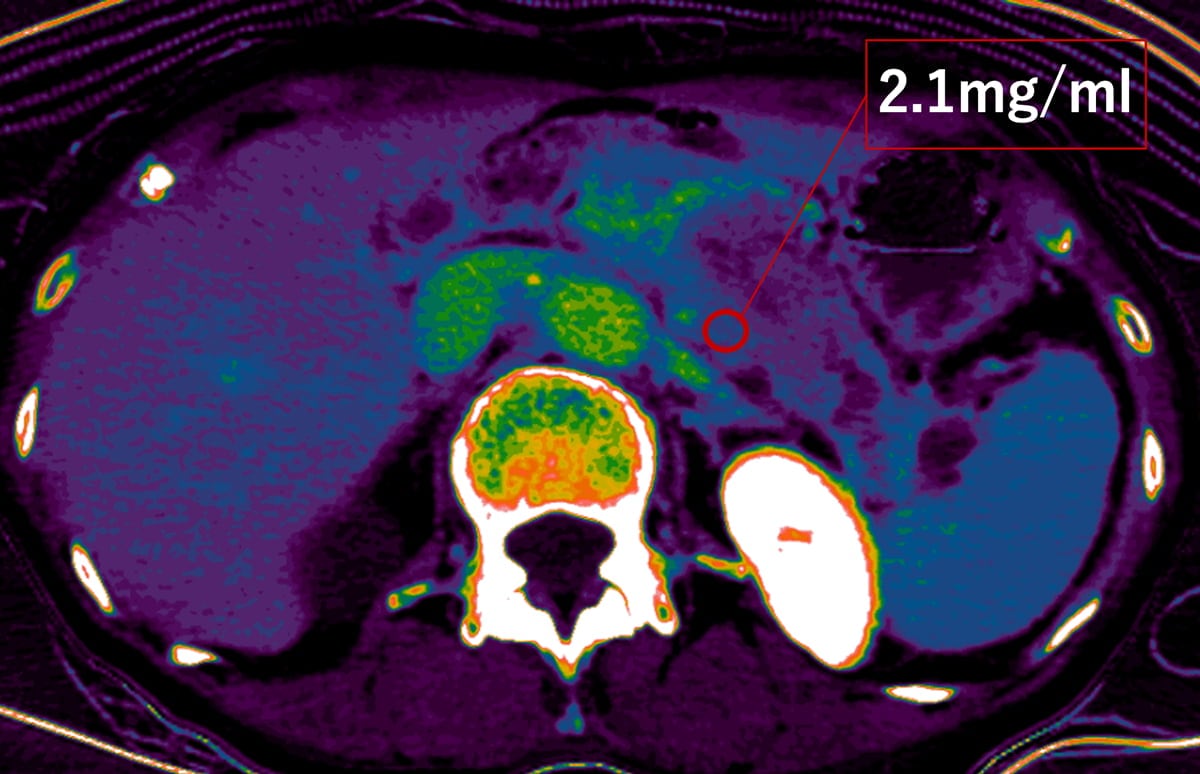
最近では、低電圧CTやdual energy CT (DECT)を用いることで、造影剤の使用量を減らしつつ、低keV画像でより造影パターンを明瞭化することで腫瘍の検出率を向上させられるようになっている。抗癌剤のデリバリー効率は線維性間質量(desmoplastic反応)に影響されることから、細胞外容積分画(extracellular volume fraction:ECV) を測定することで化学療法による治療効果を予測することが可能であると報告されている(Fujitaら。EJR2023: 162)。Single energy CT (SECT)では造影前後のCT値からECVを算出していたが、DECTでは平衡相のヨード密度だけでミスレジストレーションの影響がないECV値を定量化できるとされる。
今回の症例における腫瘍のDECT-ECV値は32%程度であった。明確な基準はないが、ある文献ではDECT-ECV値が26%以下で化学療法に感受性であるとしており、今回の症例は化学療法に抵抗性であることが予測される。
CT技術や撮像プロトコル設定について
当院のDeep learning画像再構成法(DLIR)を組み込んだGE社のDECTでは,低管電圧と高管電圧の異なる2つのraw dataから,deep learningを用いて高画質の水密度画像とヨード密度画像を生成し,それを基にノイズ成分が低減された高品質な各種画像が再構成される。従来のSECTでは1つの管電圧(120kVpである場合が多い)で撮像を行いCT値の情報を得ているのに対し、DECTでは2つの管電圧(当院では140kVpと80kVp)を用い撮像を行うことで、2種類の異なるX線エネルギーが得られる。この2種のX線エネルギーを解析することで仮想単色X線画像という低エネルギーから高エネルギーまで仮想的な単一エネルギー撮影により作成されたCT画像を任意に再構成できる。
低エネルギーレベルの仮想単色X線画像を使用することでヨード造影剤のコントラストがより増強するものの、画像ノイズが増加するという欠点がある。そこで,DLIRを用いることで強力にノイズを抑制でき,低keV画像でも臨床に耐えうる画質が取得できる。
本検査は食道静脈瘤が認められたことから、肝臓プロトコルによる撮像を行っている。膵臓をターゲットとするのであれば、動脈相よりタイミングをもう少し遅らせた膵実質相を撮像するべきである。また、ECVを評価する際は、十分造影剤が間質に到達した時相が好ましく、本検査で施行した180秒後の平衡相の撮像は、早すぎると予想される。