症例・導⼊事例
※ご紹介する症例は臨床症例の一部を紹介したもので、全ての症例が同様な結果を示すわけではありません。
造影CTでの肺動静脈奇形(肺動静脈瘻)の塞栓術前評価
施設名: 横浜市立大学附属病院
執筆者: 放射線診断科 小山 新吾 先生、宇都宮 大輔 先生 / 放射線部 泉 敏治 先生
作成年月:2024年9月
※ 効能又は効果、用法及び用量、警告・禁忌を含む注意事項等情報等については、電子添文をご参照ください。
はじめに
症例背景
60歳代、女性、50kg、肺動静脈奇形(肺動静脈瘻)
検査目的
肺動静脈奇形(肺動静脈瘻)
IVR治療前の精査目的に造影CTを施行
使用造影剤
イオプロミド300注シリンジ「BYL」/ 100mL
症例解説
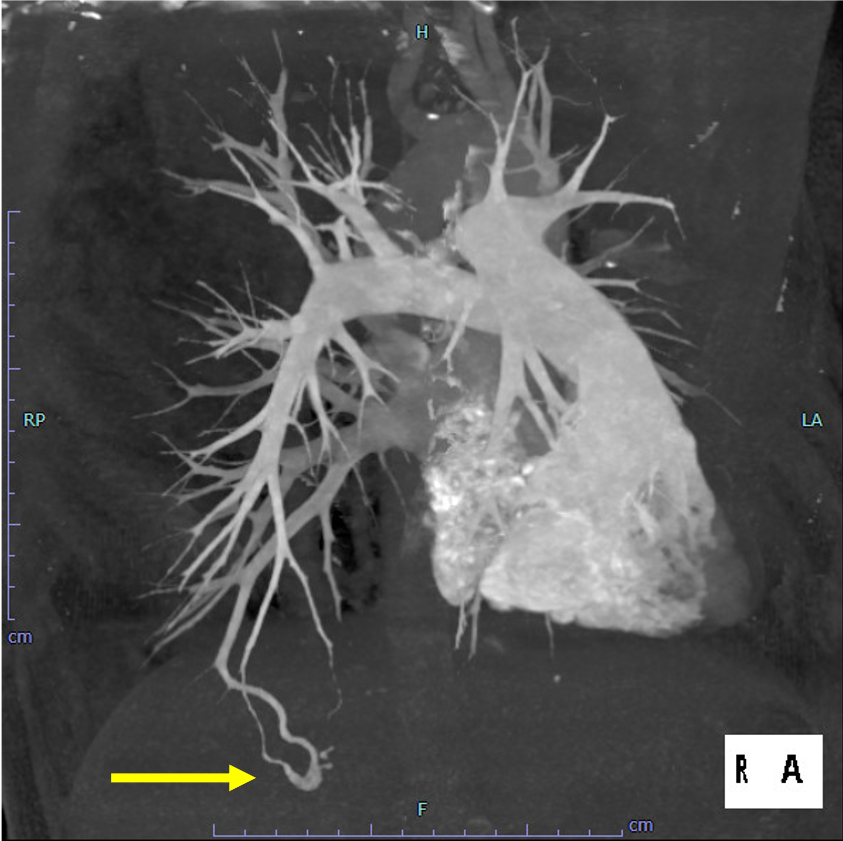
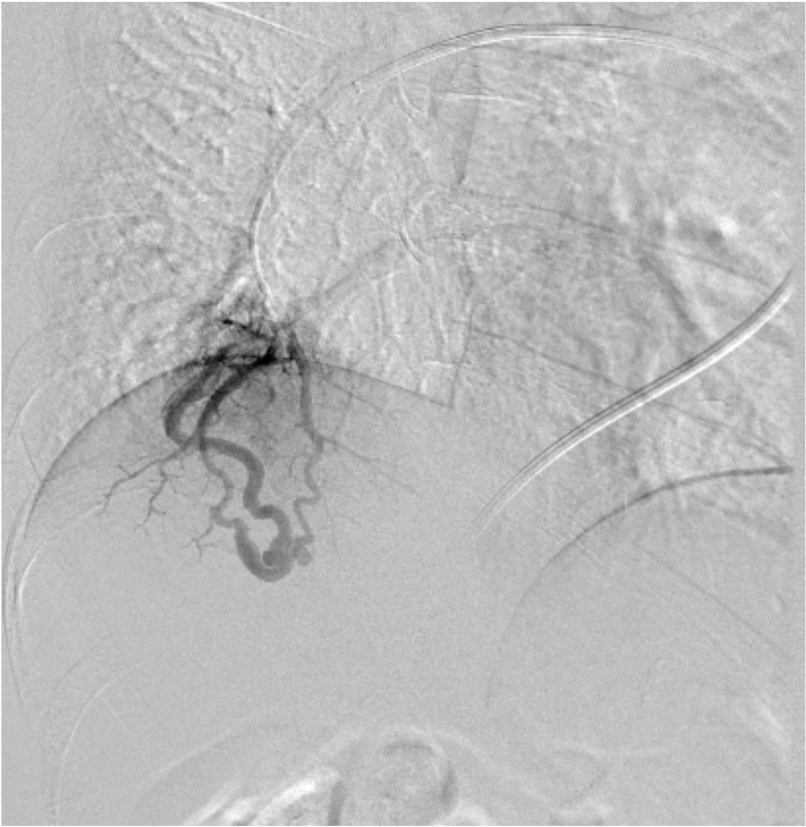
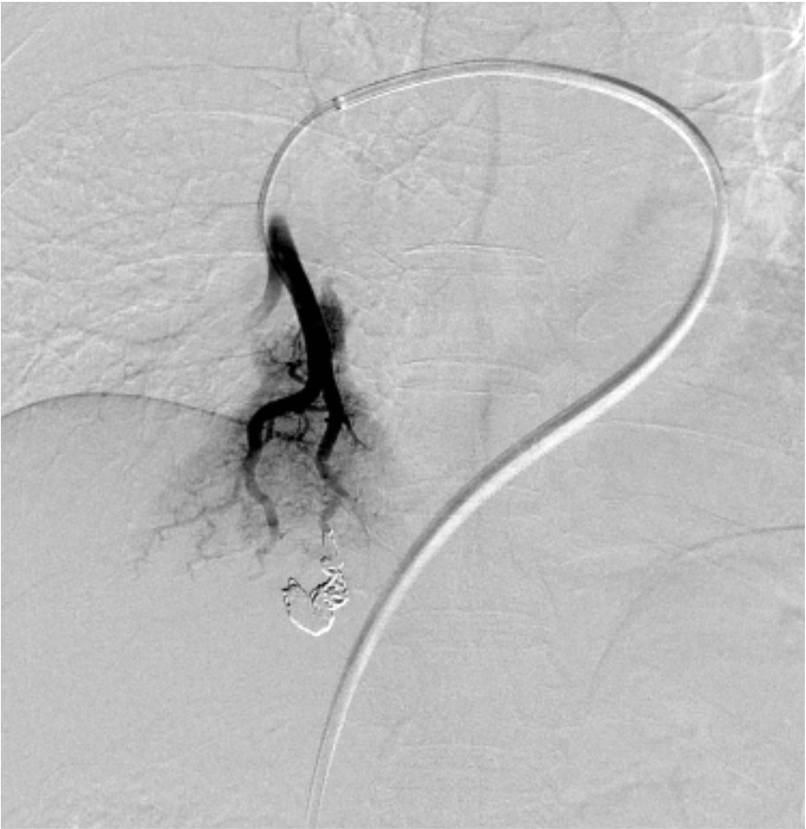
尿路の精査目的で施行した単純CTで, 偶発的に右肺下葉に肺動静脈奇形を認めた. 症状はなく, 流入動脈径は細径であったが, 今後, 脳梗塞などの神経学的合併症を引き起こす可能性があることから, 血管塞栓術の方針となった. 治療方針決定のため, 造影CTを施行した. 造影CTを参照して血管造影, コイル塞栓術を施行し, 良好な治療効果が得られた.
撮影プロトコル
表は横スクロールでご覧いただけます。
| 使用機器 | CT機種名/メーカー名 | SOMATOM Definition AS+ / SEMENS |
| CT検出器の列数/スライス数 | 64列128slice | |
| ワークステーション名/メーカー名 | ZAIO Station / ZAIO soft |
撮影条件
表は横スクロールでご覧いただけます。
| 撮影時相 | 単純 | 肺動脈相 | 肺動静脈相 |
| 管電圧 (kV) | 120 | 120 | 120 |
| 管電流時間 (Eff.mAs) | 190 | 190 | 190 |
| ビーム幅 | 0.6×128 | 0.6×128 | 0.6×128 |
| 撮影スライス厚 (mm) | 0.6 | 0.6 | 0.6 |
| 焦点サイズ | L | L | L |
| スキャンモード | Helical | Helical | Helical |
| スキャン速度(sec/rot) | 0.3 | 0.3 | 0.3 |
| ピッチ | 1.2 | 1.2 | 1.2 |
| スキャン範囲 | 胸部 | 胸部 | 胸部 |
| 撮影時間 (sec) | 4 | 4 | 4 |
| 撮影方向 | 頭⇒足 | 頭⇒足 | 頭⇒足 |
再構成条件
表は横スクロールでご覧いただけます。
| 単純 | 肺動脈相 | 肺動静脈相 | |
| ルーチン:再構成スライス厚/間隔 (mm/mm) | 3 / 3 | 3 / 3 | 3 / 3 |
| ルーチン:再構成関数/逐次近似応用法 | SARIRE 1 | SARIRE 1 | SARIRE 1 |
| 3D/MPR用:再構成スライス厚/間隔 (mm/mm) | 0.6×0.3 | 0.6×0.3 | 0.6×0.3 |
| 3D/MPR用:再構成関数/逐次近似応用法 | SARIRE 1 | SARIRE 1 | SARIRE 1 |
造影条件
| 自動注入器機種名/メーカー名 | デュアルショットGX7 / 根本杏林堂 |
| 造影剤名 | イオプロミド300注シリンジ |
表は横スクロールでご覧いただけます。
| 撮影プロトコル | 肺動脈相 | 肺動静脈相 |
| 造影剤:投与量 (mL) | 100 | |
| 造影剤:注入時間 (sec) | 30 | |
| 生食:投与量 (mL) | ー | ー |
| 生食:注入速度 (mL/sec)、注入時間 (sec) | ー | ー |
| スキャンタイミング | 固定法 | 固定法 |
| ディレイタイム | 注入開始10秒後 | 注入開始30秒後 |
| 留置針サイズ (G) | 22 | |
| 注入圧リミット (kg/cm2) | 10 | |
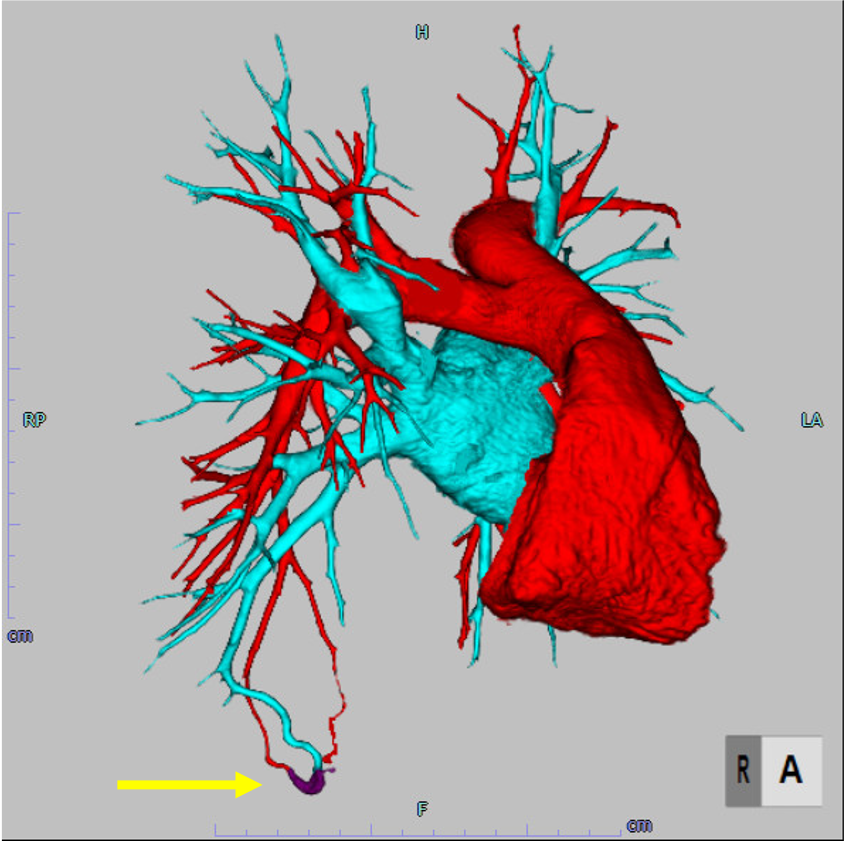
肺動静脈瘻の評価として検査依頼を受けたため、固定法により肺動脈相と肺動静脈相での撮影を行った。治療の一助となるよう肺動静脈相より肺動脈相をサブトラクションし肺動脈、肺静脈を色分けし3D作成を行った。
当該疾患の診断における造影CTの役割
肺動静脈奇形(肺動静脈瘻)の塞栓術の重要性は近年高くなっており, 術前造影CTでの解剖学的評価, 治療戦略が重要である. 従来は3mm以上の流入動脈をもつ肺動静脈奇形が塞栓術の適応とされていたが, 3mm以下の小さな流入動脈をもつ肺動静脈奇形でも重篤な脳神経合併症を起こすことがあり, 現在は流入動脈のサイズに関わらず治療適応と考えられている1-2).
肺動脈は体動脈よりも壁のコンプライアンスが高いため伸縮しやすく, また肺動脈内では線溶系が亢進しているため血栓が溶解されやすい状態とされる. そのため肺動静脈奇形では塞栓術後の再発率が高いことが報告されており, 再発を予防するためには適切なコイルサイズ, 十分な量のコイルを使用するtight packingが必要である. 肺動静脈奇形では複数の流入動脈を有するものも少なくなく, 術前CTにて流入動脈の解剖を十分検討することが重要である.
CTでの再発診断では塞栓部分の末梢側のvenous sacや流出静脈が縮小している場合に閉塞が得られているとされるが, 留置されたコイルのアーチファクトにより正確に病変の縮小率が評価できないことが問題である. 近年, 金属アーチファクト低減技術の有用性が報告されており3), 正確な再発診断に寄与する可能性がある.
【参考文献】
- Pollak JS, Saluja S, Thabet A, et al: Clinical and anatomic outcomes after embolotherapy of pulmonary arteriovenous malformations. J Vasc Interv Radiol 17: 35-44, 2006
- Müller-Hülsbeck S, Marques L, Maleux G, et al: CIRSE Standards of Practice on Diagnosis and Treatment of Pulmonary Arteriovenous Malformations. Cardiovasc Intervent Radiol 43: 353-361, 2020
- Asano Y, Tada A, Shinya T, et al.: Utility of second-generation single-energy metal artifact 29 reduction in helical lung computed tomography for patients with pulmonary arteriovenous malformation after coil embolization. Jpn J Radiol 36:285-294, 2018
CT技術や撮像プロトコル設定について
3Dの作成も考慮していたため, 造影剤投与量は600mgI/kgとした. 肺動脈と肺静脈を分離して3D作成する事を目的としていたため, 固定法による肺動脈相, 肺静脈相の2相撮影を行った.